| Autor: | Paulo Cesar Naoum | |
| Alia Fernandes Maluf Naoum (Filme) |
ANÁLISE LABORATORIAL PARA O DIAGNÓSTICO DAS HEMOGLOBINOPATIAS

Tempo do video: 20 min.
Tamanho: 1,07 Mb
Introdução:
A solicitação por parte do médico de um exame específico para confirmar a suspeita clínica de determinada hemoglobinopatia, por exemplo, doença falciforme, geralmente se faz apenas pelo pedido da análise de eletroforese de hemoglobinas. Situação mais difícil se observa quando o paciente é clinicamente assintomático, porém seus índices hematimétricos exibem discreto grau de anemia microcítica (ex.: VCM: 73 fL) e hipocrômica (ex.: HCM: 21 pg), como ocorre frequentemente nas talassemias alfa e beta menor.
Por outro lado, nem sempre a eletroforese ou a cromatografia (HPLC) de hemoglobinas oferecem resultados satisfatórios, pois há várias situações que impedem conclusões seguras. Por exemplo: um paciente portador de talassemia beta menor, que geralmente tem a Hb A2 com concentração elevada, pode mostrar níveis normais dessa hemoglobina se tiver associada a anemia ferropriva – a deficiência de ferro interfere na síntese da Hb A2, tornando-a com valores diminuídos.
Por razões semelhantes aos exemplos mostrados acima é fundamental que sejam fornecidas pelo médico duas informações básicas:
a – resumo clínico do paciente, inclusive com relato referente a tratamentos usados (ex.: ferroterapia sem sucesso na correção da anemia);
b – resultado(s) de hemograma (s) do paciente.
Com essas informações é possível estabelecer um planejamento de análise laboratorial que permitirá ao profissional de laboratório concluir com segurança o laudo de suas análises.
Apresentamos, a seguir, as três fases que compõem o planejamento de análises laboratoriais para o diagnóstico das hemoglobinopatias.
Primeira fase ou fase seletiva
Essa fase é composta por análises laboratoriais que permitem identificar os principais genótipos de hemoglobinas variantes (AS, ASH, SS, SC, SF, AC, ACH, CC, CF) e de talassemias (AA2h, AF, AH). Essas análises são as seguintes:
a – Eritrograma (Hb, VCM e HCM)
b – Morfologia eritrocitária
c – Eletroforese de hemoglobina em pH alcalino
d – Teste de resistência osmótica em NaCl 0,36%
Eritrograma – é um exame importante, pois auxilia na identificação de talassemias beta menor, alfa menor, interação entre talassemias alfa e beta com Hb S ou com Hb C, principalmente. Além disso, é um fator decisivo na diferenciação de genótipo da Hb SF da anemia falciforme com Hb Fetal elevada em comparação com o outro genótipo da Hb SF observado na interação entre Hb S e talassemia beta. A tabela abaixo exemplifica bem a importância do eritrograma nesses e em outros casos.
Tabela 1 – Genótipos de Hb S relacionados a valores do eritrograma.
Genótipos |
Hb (g/dL) |
VCM (fL) |
HCM (fL) |
Hb S (%) |
Hb F (%) |
SS* |
5 – 9 |
N |
N |
94 – 98 |
0 – 2 |
SF* |
5 – 9 |
N |
N |
80 – 90 |
5 – 20 |
SF** |
7 – 10 |
D |
D |
80 – 90 |
5 – 20 |
SF*** |
10 – 14 |
N |
N |
60 - 80 |
15 – 30 |
* : anemia falciforme ou Hb SS com ou sem Hb Fetal elevada.
** : anemia falciforme com Hb Fetal elevada ou SF na S/Beta Talassemia.
*** : anemia falciforme com Hb Fetal elevada devido à persistência hereditária de
Hb Fetal.
Morfologia eritrocitária – é uma análise que fornece “pistas” de talassemias, doença falciforme e até de Hb Instáveis. O esfregaço pode ser corado ou sem coloração. O esfregaço corado é melhor obviamente, pois mostra intensidade de hipocromia, de policromasia, de inclusões eritrocitárias, presença de eritroblastos, entre outros. As duas figuras abaixo mostram células características de talassemia beta.
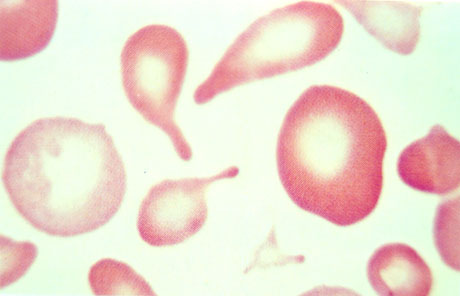
Figura 10.1 – Esquisócitos e dacriócitos na talassemia beta menor. O macrócito da esquerda com discreta policromasia é provavelmente um reticulócito circulante, enquanto que o macrócito da direita se deve à deficiência de folatos – situação comum em portadores de talassemia beta menor e outras anemias hemolíticas crônicas.
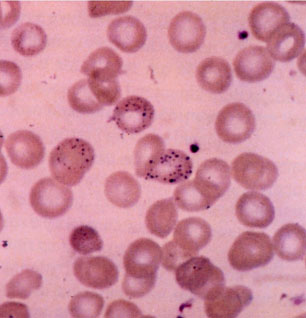
Figura 10.2 – A foto mostra em seu centro três eritrócitos com pontilhados basófilos em paciente com talassemia beta menor.
Eletroforese de hemoglobina em pH alcalino – essa análise permite a separação dos principais genótipos de hemoglobinas variantes e talassemias. A sua avaliação é qualitativa, podendo em algumas situações supor que determinada fração de hemoglobina esteja elevada. A figura 10.3 mostra nove aplicações de amostras de sangue hemolisado com saponina a 1%. É sempre importante aplicar amostra padrão (Hb AA) para fins comparativos. Observe nessa foto a Hb A2 diminuída em paciente com ferropenia, a dupla heterozigose de Hb AGC com quatro frações, e as variantes AC, SC, SF, SS e AS.
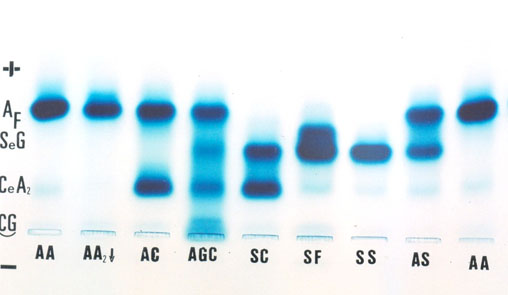
Figura 10.3 – Fracionamento de vários genótipos de hemoglobinas em eletroforese feita em agarose alcalina pH 9,0.
A eletroforese de hemoglobina em pH alcalino quando realizado em acetato de celulose permite a visualização da Hb H que está presente e pessoas portadoras de talassemia alfa. Para identificar a Hb H são necessários alguns procedimentos:
1 – usar amostra de sangue hemolisada com saponina a 1%.
2 – aplicar excessiva quantidade de hemolisado.
3 – avaliar visualmente a presença da fração de Hb H entre 5 a 10 minutos do início da corrida eletroforética.
4 – ao comprovar a presença de Hb H, anote a ficha do paciente, pois com o passar do tempo o processo termodinâmico da eletroforese desnatura a Hb H.
A figura abaixo destaca a presença da Hb H na amostra de nº 3. Observe que a Hb A2 está diminuída no portador de Hb H – esse fato é comum na talassemia alfa.
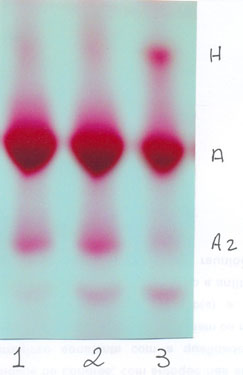
Figura 10.4 – Eletroforese alcalina em acetato de celulose. As amostras 1 e 2 são normais para hemoglobinas (Hb AA) e a de nº 3 pertence a uma pessoa com talassemia alfa (Hb AH).
Teste de resistência osmótica em NaCl 0,36% - esse teste é seletivo para identificar possíveis portadores de talassemia beta menor. Os eritrócitos esquisócitos desses pacientes não hemolisam nessa solução, tornando-a turva, conforme mostra a figura abaixo. É importante destacar que esse teste não tem valor como diagnóstico laboratorial e sua função é apenas auxiliar. A positividade também ocorre nos genótipos AC, SS, SC e SF, além de casos com anemia ferropriva intensa.

Figura 10.5 – Teste de resistência osmótica em solução de NaCl 0,36%. Pessoas com talassemia beta menor tem seus eritrócitos mais resistentes quando comparados com o padrão (Hb AA).
Segunda fase ou fase complementar
Os testes dessa fase complementam os resultados das análises obtidos na primeira fase. Por exemplo, quando se identifica a presença de Hb S em diferentes genótipos (AS, SS, SC, etc.) por eletroforese de hemoglobina em pH alcalino, não há certeza de que essa variante seja realmente a Hb S, uma vez que diversas outras variantes também migram nessa posição (ver item 9 – Lista de Hb Variantes). O teste de falcização pode resolver os genótipos de Hb AS e Hb SC, mas não resolve o da Hb SS, pois seria positivo em caso de Hb SD – A Hb D é a variante mais comum que migra na mesma posição da Hb S. Objetivamente a técnica que resolve essa questão é a eletroforese em agarose ácida que está descrita no item 11 – Técnicas Laboratoriais. Outras análises complementares são fundamentais para quantificar hemoglobinas, especialmente as hemoglobinas A2 e Fetal, a comprovação da presença de Hb H e, finalmente, a contagem de reticulócitos. Por essa razão, a segunda fase é composta pelas seguintes análises laboratoriais:
- Eletroforese em agarose ácida;
- Eletroforese alcalina quantitativa;
- Pesquisa intraeritrocitária de Hb H;
- Contagem de reticulócitos.
Eletroforese em agarose ácida – é específica para diferenciar alguns tipos de hemoglobinas variantes mais lentas que a Hb A, quais sejam: diferencia a Hb S da Hb D, e a Hb C da Hb E, pois Hb S e Hb D migram na mesma posição em eletroforese alcalina e o mesmo ocorre em relação às Hb C e Hb E. Por meio do uso da eletroforese em agarose ácida as Hb S e Hb C são mais lentas que a Hb A, enquanto que as Hb D e Hb E migram na mesma posição da Hb A, conforme mostra a representação gráfica abaixo.
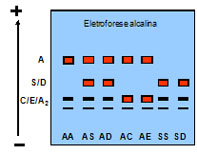
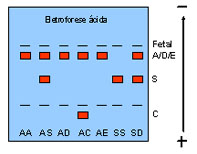
A figura 10.6 abaixo mostra a separação de três genótipos (AS, ASC e AA) em eletroforese em agarose ácida. A Hb Fetal nos três genótipos está com concentração normal.
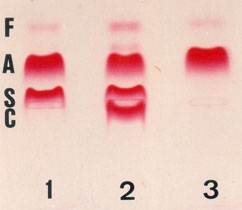
Figura 10.6 – Eletroforese em agarose ácida: (1) Hb AS; (2) Hb ASC e (3) Hb AA.
Esse sistema eletroforético permite também, com excelente qualidade de resolução, a quantificação da Hb Fetal por meio de densitometria, conforme mostra a figura 10.7. Nessa figura é possível observar a Hb Fetal com diferentes concentrações em recém nascidos (1) e (4), em dois genótipos AS (2) e (3), e no (5) em paciente com Hb SS.
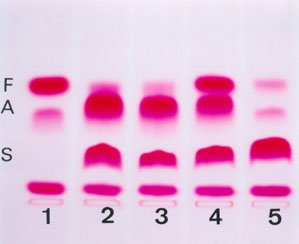
Figura 10.7 – (1) RN com 95% de Hb Fetal e 5% de Hb A; (2) e (3) Hb AS com Hb Fetal normal; (4) RN com Hb ASF e a concentração de Hb Fetal foi de 32%; (5) Hb SS com traços de Hb A proveniente de transfusão e Hb Fetal normal.
Eletroforese alcalina quantitativa – é usada especialmente para dosar a Hb A2, notadamente quando a suspeita é de talassemia beta menor. 95% dos casos de talassemia beta menor a Hb A2 está elevada com concentrações variáveis entre 4,1 a 7,5% (Hb A2 normal: 2 a 4%). A eletroforese alcalina quantitativa também pode ser empregada na dosagem de frações variantes em diversos genótipos (AS, AI, SC, SF, etc.). As quantificações podem ser realizadas por meio de avaliações densitométricas ou eluitivas que estão descritas no item 11 – Técnicas Laboratoriais.
Pesquisa intraeritrocitária de Hb H – é um teste citológico feito para comprovar a presença de Hb H identificada inicialmente por eletroforese alcalina. Os corpúsculos precipitados de Hb H no interior dos eritrócitos se devem às globinas beta “livres” que ficaram despareadas das globinas alfa devido à talassemia alfa. Os precipitados de Hb H somente são visíveis com coloração vital por meio do uso de azul de crezil brilhante a 1% ou o novo azul de metileno. A técnica, também usada para contagem de reticulócitos e pesquisa de corpos de Heinz, pode ser consultada no item 11 – Técnicas Laboratoriais. A figura 10.8 representa a precipitação de Hb H em talassemia alfa menor. Observe que a intensidade de corpúsculos precipitados é variável entre os diferentes eritrócitos e usamos uma foto em que aparece um reticulócito (RET) para mostrar a evidente diferença entre esta célula e os eritrócitos com Hb H.
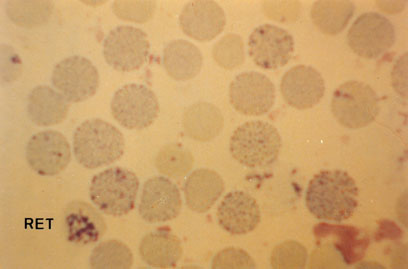
Figura 10.8 – Precipitados de Hb H no interior de eritrócitos de amostra de sangue com talassemia alfa. A esquerda, canto inferior, um reticulócito (RET) para mostrar a sua diferença em relação aos precipitados de Hb H.
Contagem de reticulócitos – é um exame complementar de grande utilidade para compor o diagnóstico de anemias hemolíticas, entre as quais se destacam a doença falciforme, talassemias maior e intermédia, e Hb Instáveis. Fisiologicamente a contagem dessas células avalia indiretamente o grau de eritropoiese em pacientes anêmicos, mas também pode ser usada como referência à resposta terapêutica da anemia e, inclusive, avaliar o grau de destruição eritrocitária que ocorre no processo hemolítico, como por exemplo na malária, anemia hemolítica auto-imune e nas Hb Instáveis.
Terceira fase específica para Hb Raras.
As análises que compõem essa fase se destinam ao diagnóstico de hemoglobinas variantes raras ou de componentes provenientes da degradação da hemoglobina como são os casos de metaemoglobina e corpos de Heinz. Assim, as análises específicas são:
- Pesquisa de corpos de Heinz;
- Testes de precipitação de Hb Instáveis;
- Dosagem de metaemoglobina;
- Eletroforese de Focalização Isoelétrica;
- Biologia Molecular.
Pesquisa de corpos de Heinz – os corpos de Heinz são produtos de globinas instáveis que se precipitam no interior dos eritrócitos e que podem ter várias causas: Hb Instáveis, toxicidade da hemoglobina causada por produtos oxidantes (NOx, SOx, sulfas, hidrazinas, etc.) e por deficiência enzimática dos eritrócitos, como a que ocorre na deficiência da enzima glicose-6-fosfato desidrogenase. Esses precipitados somente são visualizados após incubação com corantes vitais (azul de crezil brilhante e novo azul de metileno). A técnica é mesma usada para pesquisa intraeritrocitária de Hb H e na contagem de reticulócitos, conforme descrita no item 11 – Técnicas Laboratoriais. Os corpos de Heinz precipitam no interior dos eritrócitos e tem uma taxia em direção à membrana da célula, conforme pode ser observado na figura 10.9. Essa adesão dos corpos de Heinz às proteínas de membrana causa alterações na camada lipo-protéica e em especial da proteína Banda-3, expondo-a externamente. Essa exposição torna o eritrócito afetado susceptível imunologicamente à ação de macrófagos e, consequentemente, ocorre fagocitose parcial ou total dos eritrócitos, induzindo a anemia hemolítica.

Figura 10.9 – Corpos de Heinz precipitados no interior dos eritrócitos em um caso de Hb Instável.
Testes de precipitação de Hb Instáveis – as hemoglobinas instáveis são decorrentes de mutações de aminoácidos que ocupam regiões que dão estabilidade à molécula de hemoglobina. A troca de um aminoácido por outro com diferentes características (ex: tamanhos e/ou hidrofobicidade) provoca lesões na estrutura molecular da hemoglobina, deixando-a extremamente sensível ao aumento de temperatura “in vivo” (ex: febre) ou “in vitro” (teste laboratorial). Assim, as hemoglobinas instáveis (ex: Hb Koln figura 10.10) se precipitam quando aquecidas a 55ºC ou submetidas ao teste do isopropanol a 37ºC (ver item 11 – Técnicas Laboratoriais). Os precipitados são visíveis a partir de 20 minutos de incubação a 55ºC ou em 37ºC com isopropanol, conforme mostra a figura 10.11.
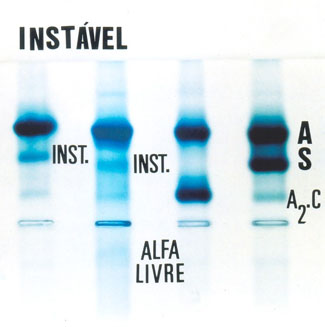
Figura 10.10 – Eletroforese alcalina em gel de agarose. As duas primeiras amostras são de Hb Koln, um dos tipos de Hb Instáveis; a terceira amostra é de Hb AC e a quarta de Hb AS. A primeira amostra de Hb Koln foi preparada com eritrócitos lavados e, por isso, não é possível visualizar as globinas alfa livres. A segunda amostra de Hb Koln foi aplicada usando sangue total e hemolisado com saponina a 1% e, por essa razão, é possível ver globinas alfa livre.

Figura 10.11 – Os três tubos com solução de isopropanol e Tris pH 7.4 pertencem ao caso apresentado na figura anterior de Hb Koln – uma hemoglobina instável com mutação na globina beta. O tubo 1 é a mistura do hemolisado com a solução, antes de ser colocado a 37ºC; o tubo 2 representa o início da desnaturação com 10 minutos de incubação; o tubo 3 mostra a precipitação da Hb Instável Koln após 20 minutos de incubação. O controle normal (Hb AA) permanece igual ao tubo 1 por 30 minutos de incubação.
Dosagem de metaemoglobina – a elevação de metaemoglobina no sangue de uma pessoa, acima de 5% de concentração, causa cianose visível na cor da pele e nas mucosas. As principais causas da elevação de metaemoglobina são: (1) Hb Instáveis; (2) deficiência de enzima metaemoglobina redutase; (3) intoxicação por produtos oxidativos, geralmente drogas medicamentosas. Informações completas podem ser encontradas no item 12 – Metaemoglobinas e a dosagem laboratorial estão descrita no item 11 – Técnicas Laboratoriais. Um destaque especial deve ser dado à relação entre elevação de metaemoglobina e doença e traço falciforme. A metaemoglobina está discretamente elevada em 50% dos portadores de Hb AS, e muito elevada em 35% dos doentes homozigotos (Hb SS). Trata-se portanto de um teste auxiliar no acompanhamento dos doentes falcêmicos.
Eletroforese de focalização isoelétrica (IEF) – é uma análise de muita sensibilidade técnica que permite a separação de frações muito próximas com excelente nitidez de fracionamento. Supera todas as técnicas de fracionamentos eletroforéticos e cromatográficos. Tem sido usada como teste auxiliar na pesquisa de Hb variantes raras (figura 10.12). Atualmente tem seu uso difundido na análise de hemoglobinas em sangue de recém-nascidos (teste do pezinho). Por ser tecnicamente refinada e economicamente muito cara, seu uso é restrito.
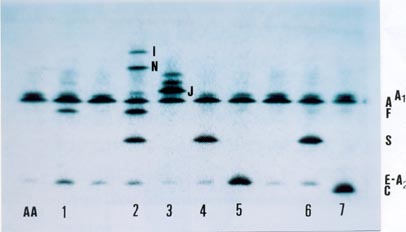
Figura 10.12 – IEF de hemoglobinas variantes raras.
Biologia Molecular - Com o advento da tecnologia do DNA recombinante, o conhecimento das alterações genéticas obteve um excepcional desenvolvimento. Esse fato permitiu, também, que se conhecessem os diferentes pontos de mutações das hemoglobinas variantes, em especial da Hb S e das talassemias.
A organização, estrutura e função dos genes que sintetizam as globinas, assim como sua localização nos respectivos cromossomos estão bem conhecidas, e esse fato têm facilitado o estudo em nível molecular das alterações das hemoglobinas.
A primeira etapa do estudo molecular é a obtenção do DNA na sua forma mais pura possível, cuja técnica segue alguns protocolos entre os quais o exposto na tabela 2. Para o estudo do DNA usam-se as enzimas (endonucleases de restrição) produzidas por determinadas bactérias e que têm a capacidade de "cortar" o DNA em pedaços com seqüências de bases nitrogenadas específicas. Para fins práticos, a presença ou ausência de um ponto de reconhecimento (sítio) de uma endonuclease de restrição é devida à sua susceptibilidade a uma determinada enzima de interesse para o estudo molecular. Duas técnicas podem ser utilizadas com esta finalidade, o PCR ("polimerase chain reaction") e o "Southern blotting".
O PCR é mais viável tecnicamente no momento, e consiste na repetição cíclica da síntese de DNA, mediada por ação enzimática por meio de iniciadores ("primers") com cerca de 20 nucleotídeos de orientação oposta, com seqüências complementares às duas extremidades do fragmento que se pretende copiar. Destaca-se que os "primers" são específicos para cada segmento de DNA que se pretende estudar. O processo de amplificação pela técnica do PCR se realiza em três etapas distintas:
- separação das fitas de DNA que se quer amplificar, a uma temperatura de 94ºC;
- ligação complementar entre os iniciadores e o DNA, a uma temperatura entre 40 e 60ºC, com formação de pequenos fragmentos de fita ;
- a síntese do DNA pela taq-polimerase (enzima obtida de bactéria resistente a altas temperaturas), a 72ºC que irá inserir os nucleotídeos complementares, originando duas fitas duplas do DNA idênticas à original.
Tabela 2 – Método para extração rápida de DNA com uso de CTAB e DTAB
Introdução Este procedimento permite a obtenção rápida de amostras de DNA genômico a partir de pequena quantidade de sangue. |
Soluções |
Etapas
|
A orientação oposta dos iniciadores faz com que a síntese de DNA ocorra na região interna entre eles. Assim, o produto da extensão de um iniciador é utilizado como substrato para outro iniciador no ciclo seguinte, resultando na duplicação de quantidade de moléculas de DNA sintetizadas no ciclo precedente, sendo que cada ciclo apresenta duração de aproximadamente 10 minutos. Após algumas horas, cerca de 30 ciclos são realizados com a possibilidade de se conseguir perto de um bilhão de cópias disponíveis do fragmento de DNA inicialmente trabalhado. As etapas da amplificação por PCR devem seguir as especificações do fabricante do equipamento termocíclico, pois serão necessários para cada estudo determinados componentes como taq-polimerase, oligonucleotídeos e "primers" específicos. Após a amplificação do pequeno segmento de DNA que contém o sítio de interesse, submeta-o à digestão com a(s) enzima(s) apropriada(s). Se houver digestão, serão gerados dois fragmentos menores do que o inicial, indicando que o sítio é suscetível à ação da enzima (representada por sinal +). Se não houver digestão, o tamanho do fragmento não se altera (representado por sinal – ). Quando há numerosos sítios polimórficos, ao longo de um complexo gênico, cada uma das diferentes combinações desses sítios no mesmo cromossomo é denominada de haplótipo. O número potencial de haplótipo é muito grande. No entanto, muitos não foram até hoje observados e, dessa forma, um pequeno número predomina nas populações humanas.
A técnica de "Southern blotting", por sua vez, consiste em digerir o DNA com uma enzima de restrição e submeter o DNA fragmentado a uma eletroforese em gel de agarose, que as separa em função de seus pesos moleculares. Após o fracionamento, o DNA é desnaturado para se obter uma simples hélice, e os fragmentos desnaturados são transferidos para um filtro de nitrocelulose, cujo procedimento é denominado por "blotting". Após a transferência, o DNA é hibridizado com sondas específicas (pedaços de DNA complementares ao gene que se deseja estudar e marcados radioativamente) formando um complexo radioativo. O excesso de sondas é lavado, e o filtro de nitrocelulose é colocado em contato com um filme que irá revelar os locais ou os segmentos de DNA que foram complementares às sondas, e finalmente analisados por meio de auto-radiografia. O padrão de restrição obtido ao final do processo indicará a presença de bandas anormais e ausência de bandas normais, evidenciando os eventuais defeitos moleculares presentes no DNA.
