Produtos da Degradação
da Hemoglobina
Autor: Paulo Cesar Naoum |
||||||||||||
Cerca
de 280 a 320 milhões de moléculas de hemoglobina ocupam
o espaço intracelular de cada eritrócito. Essa ocupação
corpuscular de moléculas é avaliada quantitativamente
no eritrograma sob a designação de Hemoglobina
Corpuscular Média (ou HCM) cujos
valores padrões normais variam entre 28 a 32 pg. Assim, essas
milhões de moléculas de hemoglobinas desempenham atividades
fisiológicas durante todo o ciclo de vida do eritrócito,
em média de 120 dias. Essa fisiologia, entretanto, não
só depende da hemoglobina e inclui ações de
enzimas que participam do metabolismo eritrocitário e da
manutenção da integridade físico-química
da dupla camada lipo-proteica da membrana do eritrócito,
conforme mostra a figura 4.5. |
||||||||||||
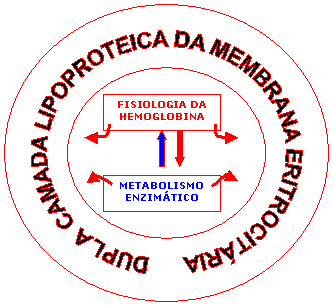 Figura 4.5 – Interação da fisiologia da hemoglobina com o metabolismo enzimático e a integridade da membrana eritrocitária. |
||||||||||||
Essa complexa inter-relação das moléculas de hemoglobinas, notadamente a Hb A, com enzimas das vias do metabolismo eritrocitário (metaemoglobina redutase, Embden-Meyerhof e Fosfoglutamato) mantém a integridade eritrocitária visualizada na figura 4.6. |
||||||||||||
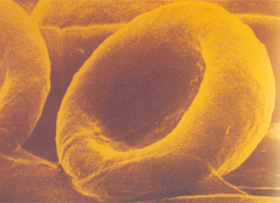 Figura 4.6 – Eritrócito normal. |
||||||||||||
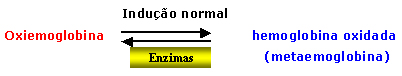
| À medida que o eritrócito se torna envelhecido, o desempenho fisiológico da hemoglobina que se caracteriza principalmente da transformação do seu estado oxigenado para a forma oxidada, com liberação do oxigênio aos tecidos, consome enzimas que equilibram esse mecanismo e em especial a metaemoglobina redutase conforme esquema abaixo: |
||||||||||||
 |
||||||||||||
Diariamente
cerca de 1% de hemoglobina total circulante (oxiemoglobina) se converte
espontaneamente em hemoglobina oxidada e que é conhecida
por metaemoglobina. Com o passar dos dias, e próximo ao 120º
dia de vida eritrocitária, a enzima metaemoglobina
redutase se consome gradualmente e como conseqüência
há formação excessiva de metaemoglobina intraeritrocitária. |
||||||||||||
|
||||||||||||
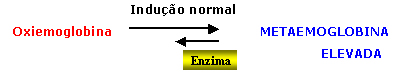
Esse
desequilíbrio em favor da formação de metaemoglobina
indica o início da degradação da hemoglobina
que trará graves conseqüências no processo interativo
entre moléculas de hemoglobinas, enzimas, proteínas
e lipídeos da membrana do eritrócito que foi mostrado
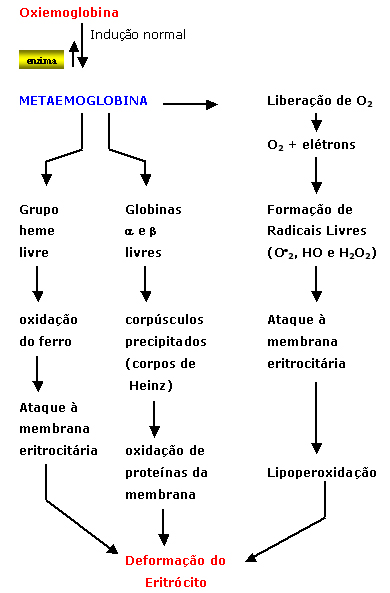
na figura 4.5. A metaemoglobina é instável, não fixa as moléculas de oxigênio (O2) difundidas no líquido celular do eritrócito e, por essa razão, a metaemoglobina começa a se degradar, conforme o esquema abaixo: |
||||||||||||
|
||||||||||||
O resultado desse processo fisiopatológico se destaca inicialmente pela deformação do eritrócito, com perda da sua biconcavidade, de alterações morfo-fisiológicas da membrana, inclusive com projeções causadas pelo acúmulo de corpos de Heinz (figura 4.7). |
||||||||||||
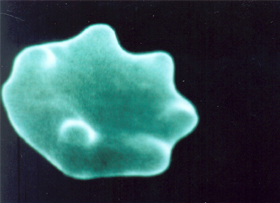
Figura 4.7 – Eritrócito deformado, com alterações morfológicas e fisiológicas da membrana causadas por precipitações de corpos de Heinz. |
||||||||||||
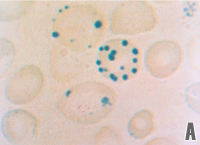
As precipitações de globinas alfa e beta livres junto à membrana do eritrócito são cumulativas e formam agregados conhecidos por corpos de Heinz. A interação entre os corpos de Heinz com a dupla camada lipoprotéica da membrana altera principalmente a proteína Banda 3 (figura 4.8a e 4.8b). |
||||||||||||
Figura 4.8 – (a) corpos de Heinz em eritrócitos com azul de crezil brilhante; (b) microscopia eletrônica plana mostrando vários corpos de Heinz agregados à membrana do eritrócito. |
||||||||||||
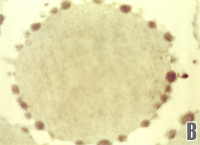
O acúmulo de corpos de Heinz junto à membrana provoca lesões oxidativas por meio de seus aminoácidos, especialmente a metionina e cisteína, que alteram a configuração molecular da proteína Banda-3 com exposição parcial de sua estrutura. Essa exposição da proteína Banda-3 modifica a membrana e, por isso, atrai a ação de macrófagos durante a passagem do eritrócito pelos microcapilares do sistema reticuloendotelial (SRE) do baço, fígado e medula. A ação do macrófago contra o eritrócito deformado pode ser saneadora (fagocitose total) ou parcial (figura 4.9). |
||||||||||||
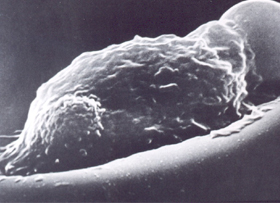
Figura 4.9 – Ação de um macrófago contra um eritrócito deformado pela presença de corpos de Heinz. Microscopia eletrônica de varredura. |
||||||||||||
A ação saneadora é a fagocitose do eritrócito inteiro, retirando-o da circulação. A ação parcial, por sua vez, decorre da retirada da(s) parte(s) do eritrócito que contém os corpos de Heinz, e o seu retorno à circulação sanguínea com a morfologia típica da “célula mordida” (figura 4.10). |
||||||||||||
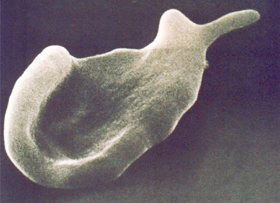
Figura 4.10 – “Célula mordida” pela retirada da parte da membrana do eritrócito devido à exposição da proteína Banda-3 causada pelo acúmulo de corpos de Heinz. Microscopia eletrônica de varredura. |
||||||||||||
Todo esse processo descrito até aqui como forma natural do envelhecimento do eritrócito pode, porém, ser utilizado também para explicar situações de metaemoglobinemia de causa patológica, hereditária ou adquiridas. As metaemoglobinemias de origem hereditária se devem à hemoglobinas variantes com oxidações espontâneas, como são os casos das Hb M, ou por indução estrutural devido à instabilidade molecular (Hb Instáveis), ou ainda por deficiência da enzima metaemoglobina redutase. As metaemoglobinemias de causas tóxicas são as mais comuns e são induzidas por poluentes tóxicos (NOx, SOx) e drogas oxidantes. Essas situações promovem transformações contínuas e cumulativas de oxiemoglobinas em metaemoglobina, com geração de muitos corpos de Heinz por eritrócito que, por sua vez, atraem a fagocitose saneadora de bilhões de eritrócitos que resultam em processos hemolíticos e anemia. |
||||||||||||
 |
||||||||||||
|
||||||||||||