Fisiologia da Oxigenação
Autores: ppppPaulo Cesar Naoum |
|||||||||||||
O
sangue do ser humano transporta diariamente o equivalente a 600
litros de oxigênio dos pulmões aos tecidos, mas pouco
deste oxigênio é transportado no plasma sangüíneo
porque ele é muito solúvel em soluções
aquosas. Quase todo o oxigênio transportado pelo sangue está
ligado à hemoglobina. Os eritrócitos ao passarem pelos
pulmões têm suas moléculas de hemoglobinas saturadas
em 96% de oxigênio (oxiemoglobina do sangue arterial) que
serão gradualmente liberados para os tecidos. No sangue venoso
que retorna ao coração a hemoglobina está apenas
64% saturada de oxigênio. Assim, o sangue que passa através
dos tecidos libera perto de um terço do oxigênio que
transporta. As propriedades especiais da molécula de hemoglobina que a transforma em um transportador tão eficiente podem ser entendidas pela comparação das curvas de ligação do oxigênio, ou curvas de saturação do O2 da hemoglobina e mioglobina (figura 3.16). Essas curvas mostram os graus de saturação de oxigênio quando mioglobina e hemoglobina estão no sangue venoso e arterial. A mioglobina tem maior afinidade pelo oxigênio que a hemoglobina. Ela está quase 100% saturada em pressões parciais de oxigênio medida em milímetros de mercúrio (pO2 / mm Hg) quando o pO2 é de 15 mmHg ou 1,5 kPa, enquanto a hemoglobina requer pO2 de 35 mmHg ou 3,5 kPa para obter 50% de saturação. Quando o hemoglobina se oxigeniza no sangue arterial seu grau de saturação é de 95%, e à medida que começa a distribuição do oxigênio para as células teciduais o faz de forma lenta até passar ao sangue venoso. No sangue venoso a liberação do oxigênio é muito rápida e eficiente, fato que faz com que a saturação de oxigênio de 75% em pO2 de 50 mmHg (do músculo em repouso) diminui rapidamente para menos de 10% de saturação em pO2 de 15 mmHg, numa curva tipo sigmóide. Assim, a curva sigmóide de saturação da hemoglobina revela uma adaptação molecular para a sua função de transporte nos eritrócitos, assegurando a ligação e a liberação do oxigênio para as células teciduais. Esse fato indica que a mioglobina tem alta afinidade pelo oxigênio em comparação com a hemoglobina. Conforme mostra a figura 3.16, o gráfico da curva de saturação da mioglobina pelo oxigênio é do tipo hiperbólica simples, fato decorrente da ação de massa do oxigênio no equilíbrio mioglobina + O2 A oxigenação da molécula de hemoglobina também depende do pH e da concentração de CO2; o aumento de CO2 induz a liberação de oxigênio pela hemoglobina, cujo processo é conhecido por efeito Bohr. Esse desempenho bioquímico se deve quando a curva de dissociação de oxigênio (curva sigmóide) em pO2 de 50 mmHg (ou P50) é afetada pelo metabolismo tecidual e pH sangüíneo. Quando o metabolismo tecidual está aumentado são liberados produtos ácidos capazes de causar a queda de pH (acidose) e assim a curva sigmóide é mudada à direita, permitindo maior liberação de oxigênio para os tecidos. Por outro lado, quando há elevação do pH sangüíneo (alcalose) a curva sigmóide se move para a esquerda, diminuindo a liberação de oxigênio para os tecidos. A curva de dissociação de oxigênio também varia em situações específicas: a) O 2,3-DPG, encontrado em grande quantidade nos eritrócitos e em pequenas quantidades nos tecidos, desvia a curva para a direita, diminuindo a afinidade da hemoglobina pelo oxigênio; b) A afinidade da molécula isolada de Hb S pelo oxigênio é a mesma que a da Hb A, porém os eritrócitos falciformes contêm mais 2,3-DPG do que os normais e, consequentemente, diminuem sua afinidade ao oxigênio. c) A Hb Fetal tem maior afinidade pelo oxigênio do que a Hb A, provavelmente devido ao fato do 2,3-DPG não se ligar às globinas gama; d) A Hb H, constituída por quatro globinas beta, tem afinidade pelo oxigênio 12 vezes maior que a Hb A; e) Há muitas hemoglobinas variantes que apresentam afinidade aumentada pelo oxigênio – Hb Bethesda, Hb Luton, entre outras – e Hb variantes que apresentam baixa afinidade pelo oxigênio, como é o caso da Hb Kansas. |
|||||||||||||
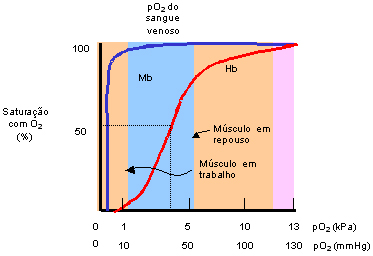 Figura 3.16 - Curvas de saturação da mioglobina (Mb) e hemoglobina (Hb) pelo oxigênio. A mioglobina tem uma afinidade muito maior pelo oxigênio que a hemoglobina. Ela está 50% saturada em pressões parciais de oxigênio (pO2) de apenas 0,15 a 0,30kPa, enquanto a hemoglobina requer uma pO2 de 3,5kPa para uma saturação de 50%. Note que embora as duas, hemoglobina e mioglobina, estejam mais que 95% saturadas na pO2 do sangue arterial que deixa os pulmões (~13kPa), a hemoglobina está apenas cerca de 75% saturada no músculo em repouso, onde a pO2 é cerca de 5kPa e apenas 10% saturada no músculo em trabalho, onde a pO2 é apenas 1,5kPa. Assim, a hemoglobina pode liberar o seu oxigênio de forma muito eficiente no músculo e em outros tecidos periféricos. A mioglobina, por outro lado, ainda está perto de 80% saturada em uma pO2de 1,5kPa e, portanto, descarrega muito pouco oxigênio, mesmo em situações de pO2 muito baixas. A curva sigmóide de saturação da hemoglobina revela uma adaptação molecular para a sua função de transporte nos eritrócitos, assegurando a ligação e a liberação do oxigênio nos tecidos apropriados. |
|||||||||||||
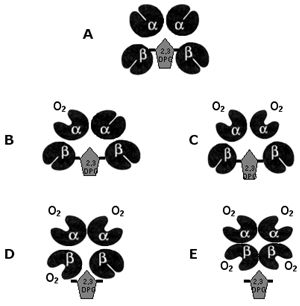 Figura 3.17 - Seqüência dos estágios da oxigenação. A) molécula de hemoglobina (Hb A) desoxigenada; B) início da oxigenação, com a fixação de uma molécula de O2 para uma subunidade de globina alfa; C) a outra globina alfa se oxigena; D) quando o O2 é fixado por uma subunidade de globina beta inicia-se o deslocamento da molécula de 2,3 DPG; E) a fixação do O2 por outra globina beta, expulsa o 2,3 DPG da molécula de hemoglobina, que se torna totalmente oxigenada. |
|||||||||||||
 |
|||||||||||||
|
|||||||||||||